
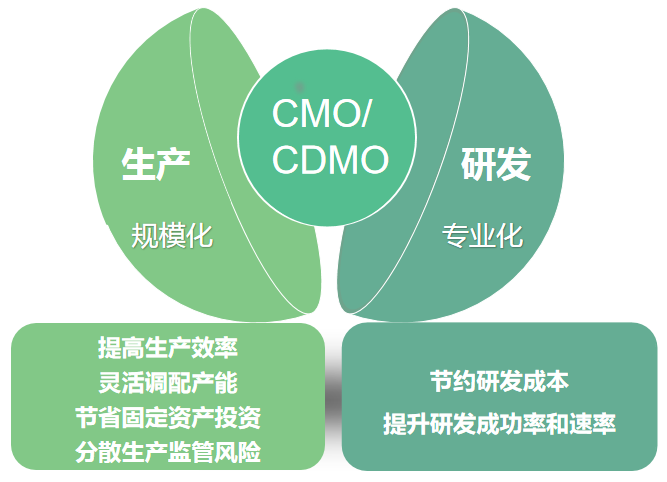
我们可根据客户对目标化合物的技术与质量要求,提供定制化产品的开发与生产,包括产品原料的筛选,生产工艺的设计及优化,检测方法、质量标准的控制以及从毫克级到公斤级的定制生产服务。
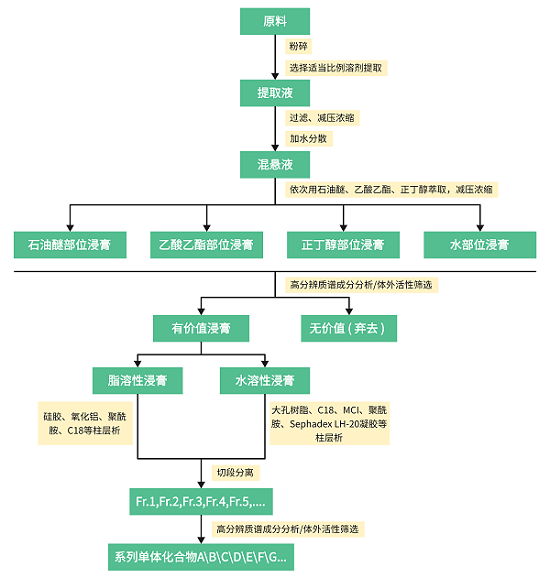
提取是指通过溶剂(如乙醇)处理、蒸馏、脱水、经受压力或离心力作用,或通过其他化学或机械工艺过程从物质中制取有用成分(如组成成分或汁液)。
分离通常是指通过适当的方法,把混合物中的几种物质分开,分别得到纯净的物质。
我们拥有众多实用性强、技术含量高的植物提取纯化设备和分离材料,大幅度提高了提取分离效率,近年持续加强生产工艺的研究与创新,可提供高效、优质的服务。
天然产物是自然界的生物体在进化过程中为了适应环境、竞争拮抗、沟通交流、抵御外侵、传递信号等而产生的功能性代谢产物。与合成化合物相比,这些化合物具有更加多样的骨架类型、更丰富的官能团和更复杂的立体构型。以上特性说明天然产物本来就是生物体“设计”出来与生物大分子/药物靶标(酶、蛋白质等)作用的,它们具有天然的亲和作用力,以及参与生物体内各种生理过程的“天然”可行性。因此,天然产物也一直是生命科学领域重要的研究对象和新药发现的重要源泉。
根据统计,目前有近60%的临床用药都直接或间接来源于天然产物或其衍生物。此外,从植物、动物中提取分离的天然产物还广泛地应用于化工行业、食品行业、化妆品行业等领域中。然而大部分天然产物自然来源极其有限,限制了对其生物及药理活性的深入研究。因此,如何快速、大量获得天然产物及其类似物已成为新药研发的瓶颈之一。
我们综合提取、分离、色谱和质谱分析等方法,对药材/植物内特征成分进行系统化研究,利用高分辨质谱分析UPLC-Q-TOF及实体数据库开展原料检测,锁定目标成分,同时依托普思生物高效的分离纯化平台,能够快速从原料中分离出稀有的、系列天然化合物。
我们的团队拥有十年以上天然产物分离纯化及制备经验,具备技术创新和研发实力,作为中国食品药品检定研究院、Sigma等国内外机构及制药企业的核心供应商之一,依托普思生物高效的分离纯化平台,能够应对复杂的化学成分分离任务,尤其是那些在结构上类似或难以分离的杂质。

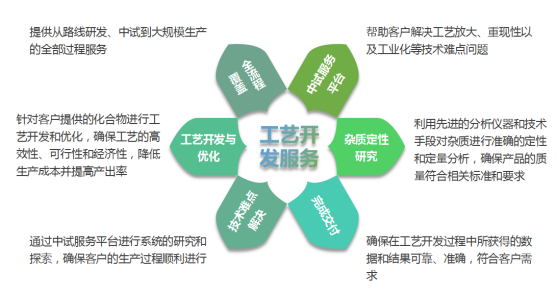
可根据客户要求开发制备工艺,以严谨的科学方法和先进的技术手段,为客户提供高效、可靠的解决方案,快速、持续、稳定的从原料中分离出百克级、公斤级产品。在生产环节实现成本降低和效率提升的双重目标,确保产品质量和满足法规要求,助力客户在激烈的市场竞争中脱颖而出。
从天然产物中寻找新药或先导化合物的研究是当前国内外创制新药的重要研究方向。天然产物提供的分子多样性和生物活性具其独特的性质,除了从天然产物直接研究开发的新药外,天然产物还是获取药物先导化合物取之不尽的源泉。我们综合提取、分离、色谱和质谱分析等方法,对药材/植物内特征成分进行系统化研究,利用高分辨质谱分析UPLC-Q-TOF及实体数据库开展原料检测,锁定目标成分,同时依托普思生物高效的分离纯化平台,能够快速从原料中分离出稀有的、系列天然化合物。
为了保证药品的质量和安全,药检部门需提前获得核准的药品标准中新增标准物质原料及有关研究资料,按照《药品注册检验程序和技术要求规范》中相关要求,药品生产单位需进行药品标准物质原料申报备案。我司拥有成都重大产业技术平台(药物标准服务平台),不断提升专业化优势并完善质量合规体系,从而提高交付物的质量及加快交付周期,可以提供对照品/对照药材标准物质原料申报资料及实物,保障客户的要求。

杂质研究是原料药研究的重要环节,它贯穿于整个药品研究的始终。杂质在原料药中含量较低,利用直接测定法无法实现杂质的定性定量分析。为实现这一要求,需要获取高纯度单一成分的杂质,需要消耗大量时间。我们有成熟的项目经验,可利用多种技术帮助客户解决这一难题。
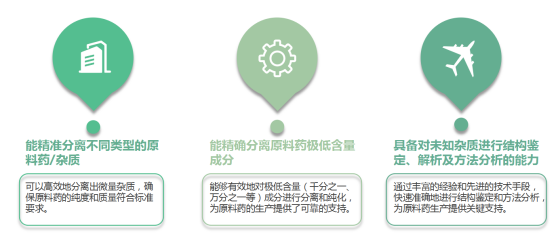
为帮助制药企业实现原料药生产的高效、稳定和可持续发展,我们可以帮助研制开发和优化生产工艺,提供全面的技术支持,从而提高生产效率、降低成本、确保产品质量和满足法规要求。我们的团队具备丰富的经验,能够应对复杂的化学成分分离任务,尤其是那些在结构上类似或难以分离的杂质,以客户需求为导向,以严谨的科学方法和先进的技术手段,为客户提供高效、可靠的解决方案,助力客户在激烈的市场竞争中脱颖而出。
天然产物往往含量较低,提取和纯化难度大提取且成本高昂。全合成难度较大,半合成是解决天然产物来源的一条有效途径。紫杉醇全合成由于步骤多、产率低、反应条件苛刻等导致成本高而无法商业化生产。以10-脱乙酰巴卡亭III为起始材料半合成紫杉醇,成功解决了紫杉醇的来源问题。天然产物是创新药物发现的重要源泉,在源于天然产物的药物发现中, 经常遇到先导化合物类药性差、药物代谢动力学特性不佳、毒副作用等问题,为了提高先导化合物的成药性,加速新药研发的进程,对先导化合物进行结构优化,已经成为目前新药研发的关键环节。
我司有专业的药物化学研究团队,可开展天然产物半合成与结构修饰研究工作。基于专业敏锐性与创新性,在骨架不变的基础上,以药物化学结构优化原则,成药性原则等理论为指导,利用生物或化学方法对天然产物中的部分结构或官能团进行结构改造,改善成药性,并提高药物活性。
依据中药新药研发的规范性要求,我司致力于为相关企业提供涵盖各类中药注册类别的高质量研发技术服务。服务内容涵盖中药创新药、中药改良型新药、古代经典名方中药复方制剂以及同名同方药等新药注册研发项目。依据中药的特性、研发规律以及实际情况,我司构建了以中医药理论、人用经验和临床试验为核心的“三结合”审评体系。此举旨在协助企业制定中药新药研发的战略规划,进行新药立项的评估工作,设计科学合理的新药研发路径和研究计划,从而有效降低中药新药研究过程中的风险。

古代经典名方中药复方制剂虽然简化了注册审批,但是对药学的研究有严格要求。研究过程包括了经典名方基准样品研制与制剂研制两个阶段。首先,制备经典名方基准样品;其次,根据经典名方基准样品开展经典名方制剂的研究,保证二者关键质量属性一致,并进行量值传递分析。
经典名方基准样品是衡量古代医籍中记载的经典名方,是否与在临床使用时的药用物质一致的标准参照,是在传统中药的大生产过程中,为保证临床疗效不降低、毒性不增加而设计的一个中间过渡对照物。其不以某些成分高低论质量,强调传统的才是最佳的选择。经典名方基准样品对药材来源、饮片炮制、配伍比例等方面进行了限定,要求除成型工艺外的制备工艺与古代医籍记载基本一致。建立从药材源头到饮片、中间体、制剂全链条的质量控制措施,确保药材—饮片—经典名方基准样品—制剂的相关性以及与临床疗效的相关性。
同名同方药物的生产开发周期短、风险小、成药率高,是已上市药物的创新研究和产业化的重点方向之一。同名同方药不同于中药仿制药,同名同方药以临床需求为导向,守正创新,要求其在有效性、安全性、质量可控性方面不低于该已上市中药的制剂。
临床适应证的精准定位和评估、药效物质基础的研究和揭示、制备工艺与临床疗效的关联性、质量控制的科学性等系列研究,是同名同方药的创制系统性的体现。以临床价值为导向,挖掘和评估所选择已上市中药对照药的优势和特点,优先考虑能够体现中医药的优势和特点的品种,对可“仿制”的已上市中药产品进行临床价值依据是否充分的科学评估和临床分析,是科学合理的选择具有临床价值对照药的先决条件。
在中医药理论的指导下,构建逐层递进、多层解析、综合评价的化学物质基础研究策略和流程,采用现代分析技术手段,对已上市药物和制备样品的不同组分进行活性对比研究,明确已上市中药组方的核心物质成分基础和非活性成分群,确定已上市药物的关键质量属性,构建已上市药物合理的功效化学物质基础指纹图谱和限度范围,是同名同方药物的创制的核心方向。以Q-Marker理念贯穿药材基原、前处理工艺、提取工艺、制剂成型工艺等环节的系统对比分析和研究之中,加强药材、饮片、中间体、制剂等全过程质量控制,全面评价和控制同名同方药整体质量,切实提升同名同方药物的质量控制水平。
医疗机构中药制剂特点为组方合理,疗效确切,安全性高,有较长的临床应用历史,具有独特的临床疗效和制备工艺,是中药新药创新的重要来源。在保证其疗效和安全性的基础上,进一步开发研制为中药新药的风险大大降低。全面、客观地评估中药医院制剂的开发价值,是医疗机构中药制剂开发研究的首要环节。基于国家对医疗机构制剂注册管控要求的不断严格,需要医疗机构制剂注册研发更加聚焦于疗效确切、工艺稳定合理和质量标准完善。
针对医院制剂生产单位相对规模较小,资金与人才匮乏、技术及设备相对落后,制剂生产规范化水平不高和质量标准不够的现状。可不断总结生产与质量控制要点,结合单位实际情况提高并制定内控标准,在遵守《医疗机构制剂配制质量管理规范》(GPP)的前提下,长期投入资金,改善生产环境,有条件的还可参照《药品生产质量管理规范》(GMP)进行生产与质量管理,不断提升医院制剂生产与质量控制水平。
普思公司可针对上述医疗机构中药制剂开发研究的特点,提供医疗机构中药制剂注册研发,生产与质量控制提高,以及基于医疗机构中药制剂的中药新药开发服务。
基于历史和现实的原因,中药已上市品种有不少的中药生产工艺变更研究需求。为紧密结合国家对已上市中药工艺变更的管控要求,对已上市中药品种的研发和生产、产品的性质充分调研和了解,按照药品生产质量管理规范等有关要求建立药品质量保证体系,建立药品上市后变更控制体系,加强对变更活动的风险评估,评价变更对产品质量和临床使用的影响,最大限度和最有效地降低变更导致的风险。
在风险评估的基础上,结合实际开展药学研究,研究内容主要包括工艺研究和质量研究。变更前后的质量比较和一致性评估,研究验证内容可通过出膏率(干膏率)、浸出物、指纹图谱(特征图谱)以及多种成份含量等药用物质基础研究的比较,充分说明变更前后质量的一致性。
包括药材检测、炮制、标准汤剂制备、中试样品研究、质量标准建立等。质量标准研究包括制法、性状、鉴别、检查、特征图谱或指纹图谱、含量测定等研究内容,采用与标准汤剂作对比研究,充分考虑样品制备过程中的量值传递。
400多个配方颗粒质量研究,几乎涵盖常用药材,涉及到TLC薄层鉴别方法学研究400余项、指纹或特征图谱方法学研究260多项,HPLC全套含量方法学研究380余项,包括罂粟、细辛、附子、青木香等多味毒性药材检查项研究,并制定合理的限度控制标准。其中10余个为国标研究标准。我司积极布局中药配方颗粒产业,协助原六家试点中药配方颗粒企业,提供申报配方颗粒标准备案用中药化学对照品。
目前中药饮片的炮制不规范现象严重危害了中药饮片的品质和药效,同时也对消费者的身体健康造成了潜在的威胁。我司可以帮助中药饮片生产企业建立饮片炮制规范,提高生产工艺水平,健全质量管理体系,从而提高中药饮片的质量水平。对现有临床疗效较好、市场占有率较高的中药品种在临床定位、物质基础、作用机制、生产工艺、质控水平等方面进行现代化研究,提升中成药标准水平,不断完善标准体系。
我们拥有成都市中试平台(中药创新药产业领域)——普思生物中药创新药物中试研发服务平台,从事中药创新药物、现代中药共性关键技术、中药质量标准体系构建等中药行业核心问题研究,开展颗粒剂、片剂、散剂等多种剂型的中药创新药物检验检测、二次开发、药品工艺验证、药品工艺改进、工艺放大熟化、小试研究、预中试研究、中试研究、中试转移及技术咨询等中试技术研发服务。
我们根据客户提供的或委托我司研发的生产工艺,进行代加工服务,为制药企业以及生物技术公司提供医药产品规模化/定制生产服务。
中药材、中药饮片、原料药、辅料、制剂、食品、提取物、已知化学单体、复方及相关制品的含量测定方法进行开发、优化与验证,主要研究方法包括高效液相色谱法(紫外(VWD和DAD)和蒸发光检测器(ELSD))、气相色谱法(FID、FPD、ECD检测器)、紫外光谱法(紫外-可见分光光度计);
中药材、中药饮片、原料药、制剂、食品、提取物、已知化学单体、复方及相关制品中特征或目标成分进行鉴别及鉴别方法开发、优化与验证,主要研究方法包括显微鉴别法、理化鉴别法、薄层色谱法、液相色谱法、气相色谱法、紫外光谱法等;
复杂基质样品(中药复方等)的鉴别及含量测定方法开发、优化和验证;
针对药材、饮片、原料药、辅料、制剂、食品、提取物、已知化学单体、复方及相关制品的质量标准建立及标准提高研究。
中药炮制小试及中试规模工艺研究(可采用单因素、正交、响应面实验设计),商业规模生产工艺研究及技术转移(甲方场地),饮片炮制工艺参数摸索、优化、验证,炮制工艺规程制定及技术转移;药用辅料质量标准研究及建立(含分析方法建立);小试和中试规模饮片炮制生产,提供饮片实物(仅供研究或作样品使用);
中药、食品及相关制品中有效成分或提取物的提取(包括配方颗粒标汤、经典名方基准样品等)、纯化(含大孔树脂、硅胶、氧化铝、葡聚糖凝胶、聚酰胺、离子色谱等各类色谱纯化方法)、制剂浓缩、干燥(冷冻干燥、喷雾干燥)、成型工艺(挥发油包合、混合、干法制粒、湿法制粒等)小试和中试规模研究(可采用单因素、正交、响应面实验设计),商业规模生产工艺研究及技术转移(甲方场地),提取、纯化、制剂浓缩、干燥、成型工艺参数摸索、优化、验证,相关工艺规程制定及技术转移;小试和中试规模样品制备加工,提供提取物实物(仅供研究或作样品使用);
各类剂型的开发研究,如颗粒剂、片剂、胶囊剂、丸剂,并解决已上市产品制剂工艺中出现的生产问题。
药品、食品、提取物、已知化学单体、复方及相关制品稳定性影响因素试验(高温、高湿及强光照射试验);药品、食品、提取物、已知化学单体、复方及相关制品稳定性加速和长期试验。
普思实验室2019年1月首次通过CNAS认可(ISO 17025),拥有分析化学、药物化学等专业人员,具备丰富的检验检测和方法开发、优化、验证能力。所有技术人员均具有相关专业技术和背景,持续接受法规标准和专业技能培训,完全满足开展承检范围内各项试验需要。


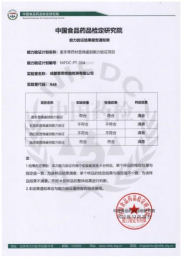
我司每年参加中检院组织的能力验证,获得满意结果10次以上,检测结果持续准确可靠。2024年4月29日,成都普思生物科技股份有限公司旗下子公司“成都普思检验检测有限公司”通过了由上海市食品药品检验研究院于2024年组织的测量审核项目“化学药品的比旋度测定”,结果为“满意”。




| 项目/参数 | 检测标准(方法) |
| 水分 | 《中国药典》2015年版四部通则0832 |
| 灰分 | 《中国药典》2015年版四部通则2302 |
| 浸出物 | 《中国药典》2020年版四部通则2201 |
| 药物引湿性 | 《中国药典》2020年版四部通则9103 |
| 含量测定 | 《中国药典》2020年版四部通则0512(高效液相色谱法) 《中国药典》2020年版四部通则0401(紫外-可见分光光度法) 《中国药典》2020年版四部通则0521(气相色谱法) |
| 鉴别 | 《中国药典》2020年版四部 通则2001(显微鉴别) 《中国药典》2020年版四部 通则0502(薄层色谱法) |
| 挥发油 | 《中国药典》2020年版四部通则2204 |
| 项目/参数 | 检测标准(方法) |
| 水分 | 《中国药典》2015年版四部通则0832 |
| 含量测定 | 《中国药典》2020年版四部通则0512(高效液相色谱法) 《中国药典》2020年版四部通则0401(紫外-可见分光光度法) 《中国药典》2020年版四部通则0521(气相色谱法) |
| 鉴别 炽灼残渣 |
《中国药典》2020年版四部通则0502(薄层色谱法) 《中国药典》2015年版四部通则0841 |
| 干燥失重 | 《中国药典》2015年版四部通则0831 |
| 残留溶剂 | 《中国药典》2015年版四部通则0861 |
| 药物引湿性 | 《中国药典》2020年版四部通则9103 |
| 熔点 | 《中国药典》2020年版四部通则0612 |
| 旋光度 | 《中国药典》2020年版四部通则0621 |
化合物必须明确化学结构,才可能进行后续的生物活性、构效关系、体内代谢以及结构改造、人工合成等研究。除了用TLC、GC、HPLC外,利用UV、IR、MS、(1H,13C) NMR、HSQC、HMBC、NOESY、COSY、CD、X-ray等现代波谱技术,对化合物平面结构及立体结构进行研究。

(1)由单一实验室采用高准确度的绝对或权威测量方法定值;
(2)由单一实验室用两种以上不同原理的已知准确度的可靠方法定值;
(3)使用一种或多种以证明准确性的方法,由多个实验室合作定值;
(4)使用一种高精密度方法与已知的一级标准物质直接比较定值;
通常对于中药或者杂质对照品所使用的标定方法为企业内部方法,在没有一级标准物质的情况下,以采用“由单一实验室用两种以上不同原理的已知准确度的可靠方法定值”居多,常用的“两种不同原理的方法”为质量平衡法与核磁定量法。
(1)质量平衡法质量平衡法是通过测量待测标准物质中水分、有机和无机杂质、挥发性溶剂等杂质总量而确定最终含量的一种定值分析方法。
含量=HPLC纯度*[100%-水分%-溶残%-炽灼残渣%]
或含量=HPLC纯度*[100%-干燥失重%-炽灼残渣%]
(2)核磁共振定量法(qNMR)qNMR是一种应用十分广泛的定量分析方法,是通过qNMR对化合物含量进行定量分析(内标绝对定量),可单独作为定量的一种方法,或作为质量平衡法定量结果的补充验证,特别适用于价值高、数量少(小于1g)的待测样品,同时适合多种成分同时分析,具有非靶向、无损、快速、绿色等特点。

化合物纯度测定一般常用各种色谱法,利用现代色谱学、波谱学和光谱学技术,进行化合物纯度分析与研究。

分析方法开发是为建立或变更方法而进行的研究活动,是结构化、系统化的设计与以风险管理为核心的研究过程。

分析方法验证(analytical method validation)的目的是证明建立的方法适合于相应检测要求。在建立药品质量标准、变更药品生产工艺或制剂组分、修订原分析方法时,需对分析方法进行验证。验证的分析项目有:鉴别试验、杂质测定(限度或定量分析)、含量测定(包括特性参数和含量/效价测定,其中特性参数如:药物溶出度、释放度等)。
分析方法转移(analytical method transfer),是一个文件记录和实验确认的过程,目的是证明一个实验室(接收实验室)在采用另一实验室(转出实验室)建立并经过验证的非法定分析方法检测样品时,该实验室有能力成功地操作该方法,检测结果与转出实验室检测结果一致。分析方法转移是保证不同实验室之间获得一致、可靠和准确检测结果的一个重要环节,同时也是对实验室检测能力的一个重要评估。

我们可根据客户的不同需求,设计科学的实验方案,开发高效的检测方法,并进行全面、准确的方法学验证,还可帮助客户建立质量标准,全方位满足客户需求。
质谱(mass spectrometer,MS)作为一种测量离子质荷比(质量-电荷比)的分析方法,可用于相对分子量与原子量的测定、有机化合物结构分析、无机元素分析、同位素分析等。在众多的分析测试方法中,质谱检测被认为测试速度快、结果精确,具有高特异性和高灵敏的普适性方法。

我司配备一套安捷伦二维液相串联高分辨质谱系统(2D-UHPLC-QTOF),它具有高灵敏度、高分辨率、高质量准确度等优势,广泛应用于化合物鉴定、成分分析、中药标准研究、杂质研究、组学研究等领域。以下是我司对外质谱业务的相关介绍。
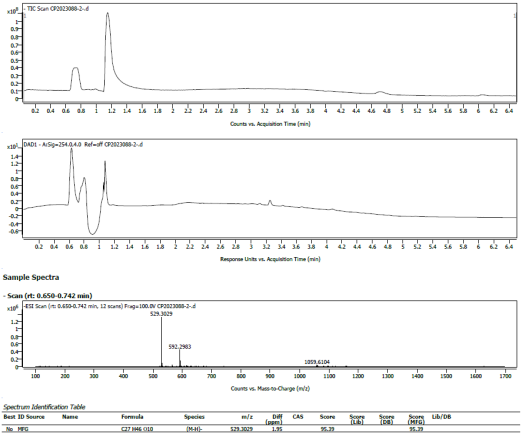
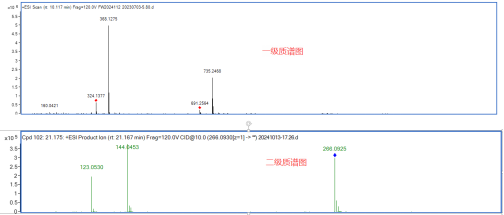
通过精确质量、同位素丰度比、同位素精确质量比及MS/MS四维信息关联分析给予推测分子量、分子式,部分化合物可通过谱库鉴定给予结构式。

依托UPLC的高效分离能力和Q-TOF的快速鉴定能力,可对中药材、浸膏/粉、复方制剂、发酵液等复杂样品的各个特征峰进行分析。,通过多维信息分析结合数据库准确推测结构式。
特别对于中药材产地溯源、道地药材质量评估,高分辨质谱有明显优势:可快速对差异成分进行定性或定量分析,有助于进一步研究产地差异。
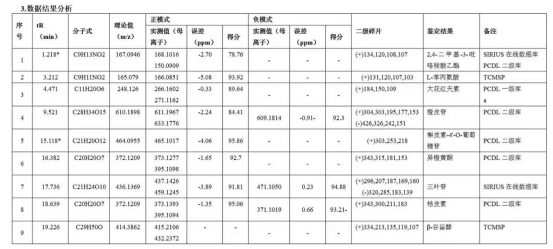
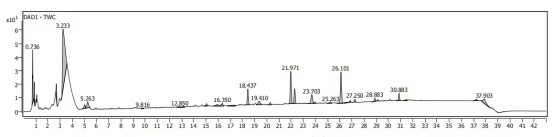
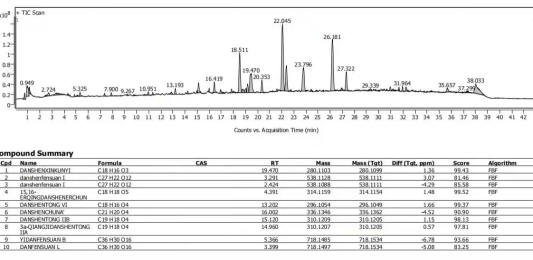
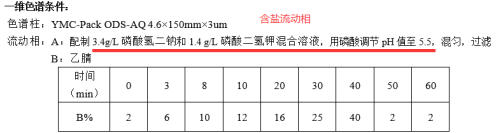
对于化药杂质鉴定而言,二维液相串联高分辨质谱系统的优势在于,可使用含盐(或离子对等)流动相,在进入二维时实现自动脱盐,无需担心盐或离子对试剂对质谱的影响,快速高效的完成杂质的鉴定;同时,也无需使用传统的纯化分离手段获得单体后再鉴定,节省时间和成本。
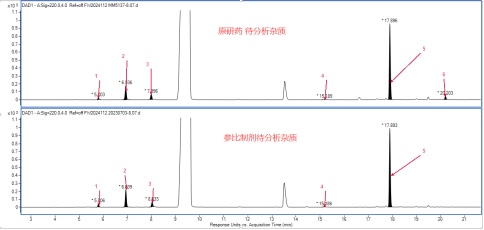

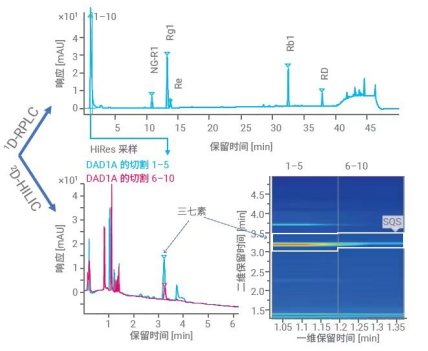
对于中药复杂组分鉴定而言,二维液相串联高分辨质谱系统的优势在于,可在二维使用不同选择性的色谱柱和色谱条件,使一维共流出的成分在二维得到较好分离,并进入高分辨质谱进行鉴定分析。
以天然产物二级质谱库为依托,鉴定分析药物原型成分,再通过高分辨质谱提取各化学成分的精确质荷比等信息对代谢产物进行辨识研究,从而分析药物代谢途径,明确药物代谢过程,为药物物质基础研究打下基础。


适用于无紫外吸收、色谱分离难度大或微量成分的定量。质谱定量具有较高的灵敏度,是传统紫外检测器的1000倍。
对于定性结果需要准确判定的,可利用我司天然产物对照品库进行对比确认;对于组分中的未知化合物,也可以通过我司分离纯化技术,获得目标化合物并进行结构鉴定。
普思优势(1)高准确性
a.植物来源成分库与天然产物二级质谱库组合比对
b.较高过滤标准与人工确认双重保证
c.正负模式同步确证
d.多次重复检测
e.质控样验证
(2)高覆盖率
a.适宜的分析体系
b.3000+天然产物图谱库(涵盖常见中药材、热门中药材的系列成分)

 关注官方微信
关注官方微信